Allosteric은 한국어로는 다른 자리 입체성 이라고 한다. 간단하게 말하면 어떤 인자가 붙을 때마다 단백질의 구조가 바뀌어서 결합력이 달라지는 것을 말한다. 헤모글로빈 뿐만 아니라 단백질로 이루어진 효소들은 Allosteric이라는 특성을 가지고 있는 경우가 많다.
1. Intro
Allosteric 이라는 단어는 처음 들으면 굉장히 낯설다. 심지어 구글에 쳐보면 한국어로도 잘 번역되어 있지 않아 난감하기도 하다. 한국어로는 다른 자리 입체성이라고 하는데, 언뜻 들으면 이해하기가 어렵다.
그러나 막상 그 개념을 이해하고 난다면 이 개념은 무지무지 쉬운 개념이다.
오늘은 생화학에서 가장 중요한 개념 중 하나인 Allosteric에 대하여 알아보자.
2. Allosteric의 개념
Allosteric은 정확히 "화학적 결합 부위에 다른 물질이 붙었을 때 단백질의 모양과 활동력(activity)가 변하는 특성"을 말한다.
그리스 어로 allos(뜻 : other, 다른) + stereos (뜻: shape, 모양) 라는 두 단어가 합쳐저 만들어진 개념이다.
이 뜻을 살펴서 간단하게 Allosteric을 설명하자면, "단백질의 다른 모양을 유도하는 특성"이라고 할 수 있다.
오늘은 예시를 헤모글로빈으로 들고왔으니, 헤모글로빈의 특성을 보면서 이야기해보자.
1) 헤모글로빈의 특성과 Taut structure & Relaxed structure
헤모글로빈에는 가운데에 heme 구조가 있고 그 주위를 2개의 helix가 둘러싼 chain이 총 4개 있는 커다란 단백질 덩어리이다.

그림에서 보다시피 이 4개의 chain 중 2개는 alpha chain이고 2개는 beta chain이다. 그리고 각각의 chain에는 산소가 붙을 수 있는 자리가 있다.
이 각각의 chain들은 산소가 붙지 않은 상태에서는 Taut structure의 상태를 지니고 있다. 영어로는 deoxygemoglobin 상태라고 한다.

그러나 산소가 붙으면 Relaxed structure 상태로 변한다 (oxyhemoglobin).

그런데 밑의 그림을 잘 살펴보면, Taut structure와 Relaxed structure 상태가 많이 다르다는 것을 알 수 있다.

Taut structure 상태에서는 산소 결합부위가 안쪽을 향해 있어 산소가 결합하기 어려운 상태인데, 산소가 결합한 Relaxed structure 상태에서는 산소 결합부위가 바깥 쪽을 향해 있어 결합하기가 훨씬 쉽다.
물론 이미 산소가 붙은 상태이기는 하지만 말이다.
2) 헤모글로빈의 allosteric
그렇다면 allosteric은 무슨 상관이 있을까?
Allosteric이란 앞에서 "화학적 결합 부위에 다른 물질이 붙었을 때 단백질의 모양과 활동력(activity)가 변하는 특성"이라고 말한 바가 있다.
헤모글로빈의 경우에 적용해서, 모두 Taut structure인 상태에서 산소 1개가 chain 1개에 붙는다고 생각해보자.
그러면 단순히 한 chain만 Relaxed structure으로 바뀔까?
그렇지 않다.
물론 다른 3개의 chain이 모두 Relaxed structure으로 바로 바뀌지는 않지만, 이 4개의 chain은 서로 연결되어 있기 때문에 한 chain의 형태가 변하면 다른 chain의 형태도 변하게 되어 있다.
위에서 언급한 그림을 다시한번 보자.
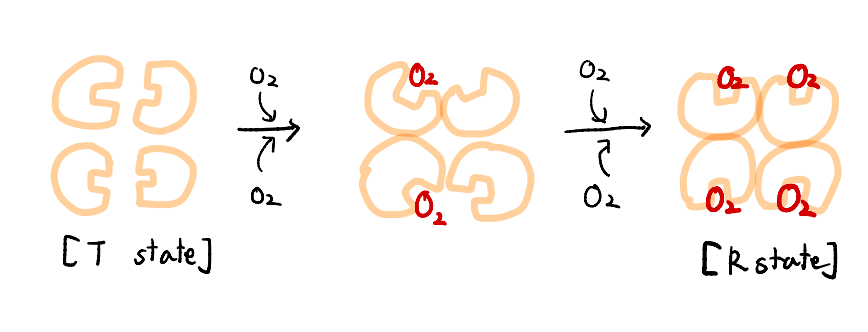
T state에서 헤모글로빈의 unit에 산소가 2개만 결합한 중간 상태의 그림을 보자.
2개의 unit만 결합한 form이 바뀐 것이 아니라 산소가 결합하지 않은 나머지 2개의 unit도 형태가 변했음을 알 수 있다.
마치 4명이 손을 잡고 둥글게 있다가 한 사람이 몸을 180도 회전시키면 나머지도 꼬이게 되어있듯이, 이 4개의 chain은 각각이 연결되어 있다.
이 연결에 의해서, 나머지 chain들도 Taut structure보다 조금 더 산소에게 열려 있는 형태로 바뀌게 된다. 완전히 Relaxed structure가 되지는 않겠지만 이전보다는 훨씬 산소에게 기회를 많이 주는 셈이다.
그렇게 되면 산소가 훨씬 붙기 쉽게 된다. 그럼 2번째 chain에도 산소가 붙기 쉬울테고, 산소가 붙는다면 또 나머지 2개의 chain이 조금 더 Relaxed structure 쪽으로 열리게끔 영향을 줄 것이다.
이렇게 연쇄작용처럼 산소가 붙으면 붙을 수록 다른 옆의 chain들도 산소가 더 잘 붙을 수 있도록 구조를 변화시키는 것이다.
이렇게 한 분자가 붙어서 단백질의 다른 구조를 변화시켜서 결합력에 변화를 가져오는 특성을 바로 Allosteric이라고 한다.
3. 헤모글로빈의 산소해리곡선
이런 Allosteric 특성을 가진 단백질들의 또다른 특성은 바로 S자 곡선이다.
영어로는 Sigmoidal shape라고 한다.
아래 그래프의 x축은 산소분압 (산소의 양에 비례하므로 잘 이해가 되지 않는다면 산소의 양이라고 생각하면 된다.) 이고, y축은 산소의 몇 퍼센트가 헤모글로빈에 붙었는지를 나타내는 산소의 포화도이다.

그래프를 살펴보면 헤모글로빈(hemoglobin)과 달리 마이오글로빈(Myoglobin)은 로그 그래프처럼 보인다.
참, 마이오글로빈은 헤모글로빈에 있는 4개의 chain 중에 딱 하나의 chain만 가지고 있다고 보면 된다.
그러니 산소가 있는 족족 붙어서 그대로 쭉쭉 그래프가 올라간다.
이에 반해 헤모글로빈은 처음에는 산소를 좋아하지 않으므로 조금 더디게 성장한다.
그러나 산소가 붙으면 붙을 수록 산소에 더 친화적으로 변해가는 Allosteric 특성이 있으므로 갈 수록 산소와 결합하는 속도가 빨라진다.
산소와 결합하는 능력을 affinity라고 하는데, 결합력 정도로 해석하면 된다.
산소의 농도가 올라갈 수록 헤모글로빈의 affinity가 높아지는 Allosteric 특성을 보인다고 할 수 있다.
이 그래프에서 보이는 이런 S자 곡선을 Sigmoidal shape라고 한다.
이것은 헤모글로빈 뿐만 아니라 Allosteric의 특성을 가지고 있는 단백질이라면 모두 보이고 있는 공통적인 특성이다.
4. 마무리
오늘은 헤모글로빈의 Allosteric 개념에 대해서 알아보았다.
또한 헤모글로빈에 산소가 결합했을 때 헤모글로빈의 산소결합력이 변한다는 것을 배웠다. 특히 산소해리곡선에서 그것이 잘 나타났다.
다음 시간에는 헤모글로빈의 Allosteric에 영향을 미치는 요인들에 대해서 정리할 것이다.
또한 우리 몸은 헤모글로빈의 Allosteric을 어떻게 이용하고 있을지에 대해서 알아보는 시간을 가질 것이다.
헤모글로빈의 Allosteric에 영향을 미치는 요인들이 정확히 어떻게 변화를 주고, 그것이 왜 중요한 지에 대해서 알아보고 싶다면 다음 포스팅을 클릭해보자.
'생화학' 카테고리의 다른 글
| 생화학 3. 아미노산의 약어, 분류와 구조, 광학이성질체(Enantiomers) (1) | 2021.12.02 |
|---|---|
| 생화학 2. Buffer의 개념과 Isoelectric point(pI)(등전점) 개념. (0) | 2021.12.01 |
| 생화학 1. 헨더슨-하셀바흐 식 Henderson-Hasselbalch Equation (3) | 2021.11.30 |