지난시간 Henderson-Hasselbalch 방정식과 특히 그 중 Ka(해리상수)의 개념에 대해서 알아보았다.
2021.11.30 - [생화학] - 생화학 1. Henderson-Hasselbalch Equation
생화학 1. Henderson-Hasselbalch Equation
아미노산에 대해 공부하는 분이라면 한번쯤 이 헨더슨-하셀바흐 방정식에 대해서 들어보았을 것이다. 처음 이 방정식을 접하다보면 이게 무슨 소린지 의아해서 구글을 미친듯이 검색하기 일
msgreen-carpet.tistory.com
<Buffer>
1) Buffer의 개념
오늘은 이 Ka의 개념을 안 후 또다른 생화학의 중요한 개념인 Buffer에 대해서 설명할 것이다.
Buffer란 무엇인가? 한국어로 버퍼라고 하면 흔히 자동자 버퍼를 생각할 수 있다. 자동차가 무언가를 들이받았을 때 그 충격을 완화시켜주는 장치를 우리는 버퍼라고 부른다.
생화학에서도 버퍼의 개념은 똑같다.
한마디로, 누군가 자극을 줘서 pH가 바뀌려고 할 때에 그 자극을 완화시켜주어서 pH가 덜 바뀌도록 도와주는 것을 Buffer라고 한다.
구체적으로는 산이나 염기가 더해졌을 때, 전체 pH가 크게 바뀌는 것을 막아주는 역할이라고 할 수 있다.
2) Buffer의 역할
그렇다면 Buffer의 역할은 누가 하게 될까?
Buffer는 기존에 존재하던 weak acid인 [HA]나 conjugate base인 [A-]가 할 수 있다.
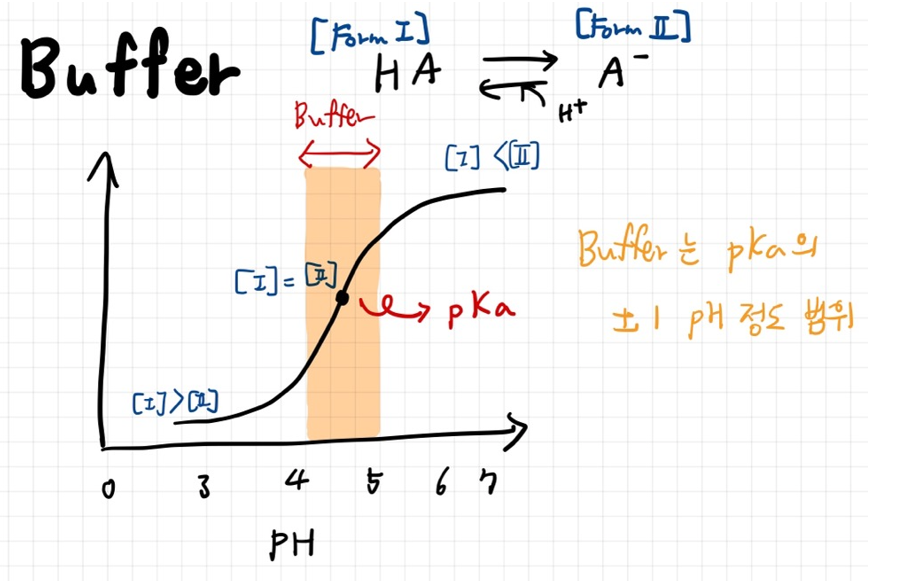
위 그림은 일반적인 짝산과 짝염기의 buffer 작용을 나타낸 것이다. x 축은 pH 농도이고, y축은 미처 표시는 못하였지만 OH-의 양을 나타낸다.
잘 보면, 원래 Form 1이 많으면 pH가 낮아지고, Form 2가 많아지면 pH가 높아진다. 그러나 pKa(해리상수)의 앞뒤 플러스 마이너스 1 정도의 pH는 Buffer가 작용하여 pH의 변화를 크게 줄일 수 있다.
참고로, 저기에서 Form 1 의 농도와 Form 2의 농도가 같은 지점이 pKa인 이유는 앞 포스팅에서 배웠다시피 Henderson-Hasselbalch 방정식에서 [HA] = [A-] 이면 pH=pKa가 되기 때문이다.
1) pH < pKa 인 경우,
강한 산성이므로 주변에 proton [H+]가 많아 weak acid form 인 Form 1이 많이 존재한다. 반면,
2) pH > pKa 인 경우,
주변에 proton [H+] 가 적으므로 주변에 proton을 뿌리느라 [A-] 상태인 Form 2가 더 많이 존재하게 된다.
이 원리로 따져보았을 때 Buffer 구간 (pKa +- 1pH) 은 [HA]와 [A-] 가 자체적으로 외부에서 들어오는 산과 염기에 대항하여 proton의 농도를 조절하느라 Form 을 변경한다는 것을 알 수 있다.
이것은 이제 일반적인 짝산과 짝염기의 내용이었고, 이제 아미노산의 산과 염기 특성에 대해서 알아보자.
<PI: Isoelectric point>
여기에서 먼저 알아야하는 개념이 있다. 바로 Isoelectric point(pI)라는 개념이다.
Isoelectric point(pI)는 어떤 아미노산에서 (+) charge와 (-) charge가 같은 지점을 이야기한다.
그 예시로 Alanine을 살펴보자.
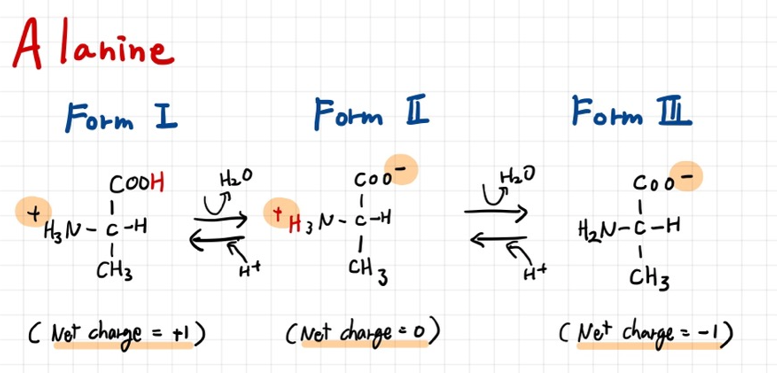
Alanine은 H+가 붙은 수 있는 부분이 2군데가 있다. 그래서 총 3개의 Form을 가지고 있을 수 있다.
그런데 이 Form 1 에서는 H+로 인해 (+1)의 net charge를 가지게 되고, Form 2에서는 (+1)+(-1)= 0 의 net charge를 가지고 있다. Form 3는 net charge가 (-1) 이다.
그렇다면 이 Alanine의 pH에 따른 OH-의 양을 그린 그래프를 살펴보자.

Alanine의 pH가 변할 때에 alanine에 대응되는 OH-의 양을 나타낸 그래프이다. 여기서 pKa의 값이 두개인 것을 알 수 있는데, 생각해본다면 alanine의 Form이 3개이므로 각각 평형을 이룰 때 pH값과 pKa 값이 같아지는 지점이 2부분 생긴 다는 것을 알 수 있다. 앞에서 하나의 짝산과 짝염기가 있었을 때는 S 커브가 하나만 있었던 것과 달리, Form의 형태가 늘어나자 pKa의 갯수만큼 S 커브의 갯수가 늘어난 것을 알 수 있다.
이것은 Form이 더 많아져서 pKa 값이 더 많아진다면 S 커브도 더 늘어날 수 있다는 점을 알려준다.
여기서 이제 위에서 배운 Isoelectric point(pI)의 개념이 나온다. Form 1과 Form 3는 각각 charge를 가지고 있으므로 pK1과 pK2에서는 전기적인 평형을 이룰 수 없다. 하지만 pI는 그 개념이 전기적인 평형을 이루고 있는 지점이다.
그렇다면 pI에서는 어떤 일이 벌어질까. 위에서 한 것과 같이 pH를 pK1, pK2로 구분해서 나눠보자.
(1) pH < pK1
이 상태는 주변에 protone [H+]가 많으므로 [Form 1]이 가장 많은 비율을 차지하고 있을 것이다. [Form 1]은 +1 의 charge를 가지고 있으므로 전체적인 전기적 힘은 positive 이다.
(2) pK1 < pH < pI
여기서는 [Form 3] < [Form 1] < [Form 2] 의 상태일 것이다. [Form 3]는 작아서 신경 안쓴다고 한다면 전체적인 전기적 힘은 역시 positive 이다.
(3) pH = pI
여기서는 charge = 0 인 구간이다! 그렇다면
[Form 3] = [Form 1] < [Form 2] 의 상태이거나, 아니면 [Form 2]만 존재해야 말이 되는 상황일 것이다.
(4) pI < pH < pK2
[Form 1] < [Form 3] < [Form 2]
Form 1이 점점 Form 2로 바뀌고, Form 2가 점점 Form 3으로 바뀌고 있다. Form 1보다 Form 3이 많은 상황이므로 charge는 negative가 되었다.
(5) pK2 < pH
[Form 1] < [Form 2] < Form 3]
압도적으로 Form 3이 많아져서 negative charge인 상태이다.
secret tip ) 이제 각 pH에 따른 상태에서 어떤 일들이 일어나고 있는지 이해가 좀 되는가? pKa와 pI에 대한 문제는 생각보다 꽤 여러군데에서 자주 나온다. 특히 pI를 구하는 문제가 많이 나오는데 꿀팁을 알려주자면, pKa가 두개면 그 두개를 평균을 구하면 되고, pKa가 3개 이상이면 그림 상으로 가까워보이는 pKa 두개를 뽑아서 평균을 내면 된다.
'생화학' 카테고리의 다른 글
| 4. 헤모글로빈(hemoglobin)의 특성, Allosteric에 대하여 (1) | 2021.12.17 |
|---|---|
| 생화학 3. 아미노산의 약어, 분류와 구조, 광학이성질체(Enantiomers) (1) | 2021.12.02 |
| 생화학 1. 헨더슨-하셀바흐 식 Henderson-Hasselbalch Equation (3) | 2021.11.30 |